2024年中國化學藥品制劑行業發展現狀、具體分類及未來發展趨勢分析預測
?
報告發布方:中金企信國際咨詢《全球與中國醫藥市場發展趨勢及競爭格局評估預測報告(2024版)》
?
中金企信國際咨詢相關報告推薦(2023-2024)
?
《醫藥項目建議書-中金企信編制》
《全球及中國化學藥品制劑行業市場占有率分析及競爭戰略評估預測報告(2024版)》
《化學藥品制劑項目商業計劃書-中金企信編制》
《2024-2030年甲基多巴(高血壓用藥)行業市場監測及投資環境評估預測報告》
《2024-2030年全球及中國益生菌行業發展趨勢分析及競爭格局評估預測報告》
?
1、全球醫藥行業發展現狀:近年來,隨著全球經濟發展、人口總量增長、人口老齡化程度加深、居民健康意識增強以及各國醫療保障體制的不斷完善,全球醫療衛生支出及醫藥市場規模保持穩定增長。根據中金企信統計數據,2016-2022年,全球醫藥市場規模由11,530億美元增長至14,950億美元,年均復合增長率為4.42%,呈現穩步上升的態勢;預計到2025年全球醫藥市場規模將達到17,524億美元,2022年至2025年年均復合增長率為5.44%。從收入構成來看,化學藥品是全球醫藥市場最主要的組成部分,2021年市場占比為75.85%。
2、我國醫藥行業發展現狀:醫藥行業是支撐發展醫療衛生事業和健康服務業的重要基礎,是具有較強成長性、關聯性和帶動性的朝陽產業,是關系國計民生、經濟發展和國家安全的戰略性產業,是健康中國建設的重要基礎。近年來,隨著我國經濟持續高速發展、居民人均可支配收入穩定增長、人口老齡化程度顯著加深、居民健康意識持續增強以及國家醫保支出不斷增長,我國衛生總費用和醫藥市場規模保持快速增長。
2012-2022年,我國衛生總費用由28,119.00億元增長至85,327.49億元,年均復合增長率為11.74%;我國衛生總費用占GDP比重不斷提升,從2012年的5.22%增長至2022年的7.05%,我國醫療衛生支出在國民經濟中的重要性水平進一步提升。同期,我國人均衛生費用由0.21萬元增長至0.60萬元,年均復合增長率為11.32%,均呈現快速上升的態勢。
2016-2022年,我國醫藥市場規模由13,294億元增長至15,541億元,年均復合增長率為2.64%,呈現穩步上升的態勢;預計到2025年我國醫藥市場規模將達到19,627億元,2022年至2025年年均復合增長率為8.09%。從收入構成來看,化學藥品是我國醫藥市場最主要的組成部分,2022年市場占比為45.73%。
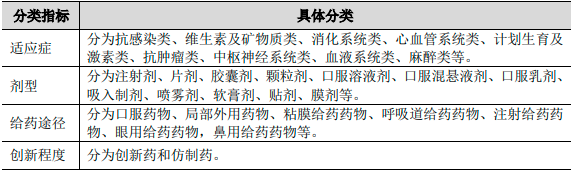
3、化學藥品制劑行業發展現狀:化學藥品制劑指直接用于人體疾病防治、診斷的化學藥品,其活性成分通過化學合成、或來源于天然物質或采用生物技術獲得,根據臨床需求制成的各種劑型。
化學藥品制劑具體分類
(1)全球化學藥品制劑行業現狀:根據中金企信統計數據:2016-2021年,全球化學藥品市場規模由9,328億美元增長至10,628億美元,年均復合增長率為2.64%,呈現穩步上升的態勢;預計到2025年全球醫藥市場規模將達到11,778億美元,2021年至2025年年均復合增長率為2.60%。
(2)我國化學藥品制劑行業現狀:作為傳統的藥物形式,化學藥品制劑一直是我國醫藥市場最主要的組成部分,根據中金企信統計數據,2021年我國化學藥品市場規模占醫藥市場的47.20%,是我國居民日常使用最廣泛和品類最多的醫藥產品。受益于國內藥品需求不斷增長、醫保體系逐漸健全以及政府醫療衛生支出不斷增加,近年來我國化學藥品制劑市場規模不斷擴大。2013-2022年,我國公立醫療機構終端化學藥銷售規模由6,331億元增長至10,210億元,年均復合增長率為5.45%,呈現穩步上升的態勢;2023年1-6月,化學藥銷售規模為5,564億元。基于我國巨大的人口基數以及未來隨著我國人口老齡化問題的逐步加劇以及醫藥衛生體制改革的不斷深化,我國化學藥品制劑市場預計仍將保持較快的增長態勢。
近年來,隨著我國正式加入ICH,以及一致性評價、藥物臨床試驗數據核查、原輔包關聯審評審批等相關措施落地,我國藥品審評注冊標準顯著提升,市場準入條件更為嚴格,行業標準及藥品質量安全進一步提升;其次,隨著我國醫保正逐步從“按比例支付”向“同一通用名等額支付”過渡,以及疾病診斷相關分組付費(DRG)/病種分值付費(DIP)等控價控量政策的出臺,原研藥價格較高的劣勢將凸顯;此外,醫藥分開政策的執行(如藥品零加成等),也將抑制醫院和醫生在處方中使用高價原研藥的意愿,而更傾向于選擇價格合理的仿制藥品種,因此未來國產仿制藥有望借助性價比逐步實現原研替代。
4、化學藥品制劑行業發展趨勢:
(1)以臨床需求為導向的研發創新將迎來快速發展:我國化學藥品制劑工業起步較晚,長期以仿制藥為主,導致我國醫藥企業的整體技術水平以及研發實力相對較弱。歷經多年,我國醫藥工業已經取得了長足的發展,隨著行業技術水平的提升、仿制藥市場競爭不斷加劇,醫藥企業正加大新劑型、新處方工藝、新給藥途徑等具有明顯臨床優勢的藥品的研發。此外,對于仿制藥而言,研發門檻較高、技術難度較大、附加值較高的仿制藥也逐步成為仿制藥企業的重點發展方向。
我國大力推進醫藥衛生體制改革,鼓勵醫藥體系自主創新,化學藥品和生物制品新分類、藥品專利糾紛早期解決機制、審評特殊通道(優先審評審批、突破性治療藥物、附條件批準上市)等政策更加支持創新程度高、臨床優勢明顯藥品的快速上市;醫保談判加快了創新藥納入醫保的速度,提高了創新藥的可及性;醫療支付體系改革則進一步加大了創新藥的支付力度。在此背景下,大量傳統醫藥企業正加快創新轉型,更加重視技術改良與創新。未來,能夠順應行業發展趨勢、把握創新研究方向的化學藥品制劑企業有望實現快速發展。
(2)一致性評價、集中帶量采購等制度重塑仿制藥競爭格局:仿制藥行業是我國醫藥行業的重要組成部分,生產企業多、批文數量多、市場占比高,其發展對于推動我國醫藥產業自主起步、解決“缺醫少藥”問題起到了重要作用,但發展至今也面臨生產企業和產品質量良莠不齊的問題。因此,近年來國家積極出臺了一致性評價、集中帶量采購等一系列產業政策,推動仿制藥行業高質量發展。一致性評價政策規定,化學藥品新注冊分類實施前批準上市的含基本藥物品種在內的仿制藥,自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價,逾期未完成的除特殊情況外將不予再注冊。此外,一致性評價政策與集中帶量采購相掛鉤,同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價的品種。
一致性評價和集中帶量采購等政策對于存量規模巨大的仿制藥市場產生了深刻影響,仿制藥行業加速出清,市場逐步向優質醫藥企業集中。從技術能力角度,對于產品質量較低、研發能力較弱的醫藥企業來說,無法通過一致性評價不僅可能會逐步喪失市場份額,還將面臨產品無法再注冊的風險,而產品質量較高、研發能力較強的醫藥企業將通過率先通過一致性評價并參與集采的模式搶占市場份額、獲取合理利潤;從市場競爭角度,集中帶量采購通過以量換價的方式降低了藥品采購價格,將在一定程度上降低部分原有市場份額較高的大型醫藥企業的盈利能力,而對于具備一定研發和成本控制能力的中小醫藥企業,集中帶量采購為其提供了實現產品快速放量的發展機會;從產品角度,未來各仿制藥品種的價值將出現分化,仿制門檻較低、通過一致性評價的批件較多的藥品品種,其在集中帶量采購招標競價過程中將面臨較大競爭壓力,擁有成本優勢的企業將具備較強的競爭優勢,而仿制門檻較高、通過一致性評價的批件較少的藥品品種,則將具備較強的競爭優勢和議價權。
對醫藥企業而言,短期內需盡可能發展仿制門檻高的藥品;長期來看,質量、品種線豐富度、價格是決定企業綜合競爭力的核心因素,儲備品種多、能率先通過一致性評價且具備成本優勢的企業將在集中帶量采購制度下持續受益。
(3)“原料藥+制劑”一體化布局的企業競爭優勢明顯:在藥品集中帶量采購政策驅動下,銷售端利潤不斷被壓縮,更有效的成本控制及質量控制已成為我國醫藥企業發展的重要方向。此外,由于原料藥企業的生產工藝及設施設備、控制措施的不同,不同企業生產的同一品類產品之間會存在一定質量差異,從而可能使得制劑產品存在潛在的質量風險,甚至引起不可預期的臨床風險,進而對制劑企業產生較大的影響。因此,制劑廠商通常會對原料藥企業進行嚴格的審計并對原料藥產品進行全面的質量評估,建立合格供應商名單。若要更換或新增原料藥供應商,制劑廠商需要對新供應商及其產品重新進行審計和評估,并開展工藝驗證和穩定性考察,完成藥品上市后變更的相關工作,時間、資金成本較高。“原料藥+制劑”一體化布局能夠在保障充足、穩定且優質的原料藥供應的前提下,有效降低成本,充分發揮協同效應,以應對市場及政策環境帶來的挑戰,從而提高市場話語權。
(4)藥品研究各領域技術要求與國際接軌:2017年6月,原國家食品藥品監督管理總局正式加入ICH;2018年6月,國家藥品監督管理局進一步成為ICH管理委員會成員。目前我國基本完成了ICH指導原則轉化實施,截至2022年末國家藥品監督管理局累計實施了全部3個ICH一級指導原則、全部5個二級指導原則以及58個三級指導原則。
加入ICH并全面推進ICH指導原則轉化實施標志著我國藥品研發和審評技術要求的提升以及與國際藥品研發技術的接軌,有助于深化我國藥品審評審批改革,提升我國藥品監管能力建設國際化水平,推動我國藥物研發創新,促進我國醫藥創新體系與國際接軌和互認升級,深度融入全球創新體系。
(5)行業監管趨嚴化:近年來,隨著《藥品管理法》《藥品注冊管理辦法》《藥品生產監督管理辦法》和《藥品上市后變更管理辦法(試行)》等一系列法規的修訂和施行,我國藥品行業監管呈現愈發嚴格的趨勢。
上述政策對國內醫藥企業在研發、生產、質量控制等方面提出了更高的要求,一方面將有利于提高我國藥品質量的整體安全水平,另一方面也將促進行業良性循環和醫藥企業的優勝劣汰,未來標準化、規范化的企業有望獲得長期的發展機遇,具有全球視野和競爭力的企業,有望參與國際化競爭。
?
?