2023年中國人血清白蛋白藥物行業(yè)市場需求���、供給及重點企業(yè)競爭規(guī)模評估預(yù)測
?
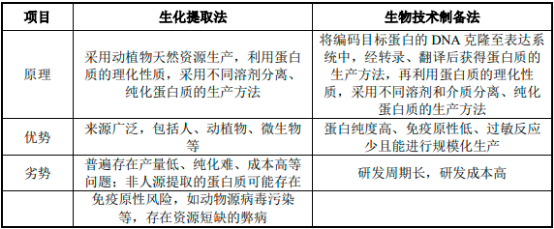
(1)人血清白蛋白藥物的制備:
①生化提?�。?/span>目前���,絕大多數(shù)國內(nèi)外企業(yè)從血漿中分離純化人血清白蛋白采用低溫乙醇法����。低溫乙醇法是以混合血漿為原料,通過逐級降低酸度(從pH7.0降到pH4.0)、提高乙醇濃度(從0%升到40%)���、降低溫度(從2°C降到-2°C)的方式,使得各種蛋白在不同分離條件下分步從溶液中析出,并通過離心或者過濾的方法獲得各目標(biāo)組分。以此方法從血漿中得到人血清白蛋白原液后,經(jīng)超濾���、配制、巴氏滅活、除菌過濾分裝等處理,可得到人血清白蛋白成品。
②生物技術(shù)制備:由于市場需求量大�,單靠人血漿提取人血清白蛋白難以滿足市場的需求����。近年來���,國內(nèi)外學(xué)者正積極開發(fā)研究采用基因工程技術(shù)生產(chǎn)重組人血清白蛋白替代血漿提取pHSA的技術(shù)�。
盡管生化提取法來源廣泛,但其普遍存在產(chǎn)量低、純化難�、成本高�����、可能存在傳播血源性疾病的潛在風(fēng)險等問題�����。相較而言���,通過基因工程法獲得的重組人血清白蛋白純度高�、免疫原性低�����、過敏反應(yīng)少且能進行規(guī)?�;a(chǎn)。因此���,蛋白藥物的生產(chǎn)方式呈現(xiàn)出以生物技術(shù)制備取代生化提取的趨勢。上述兩種制備方法的原理與各自優(yōu)劣勢比較如下:
 ?
?
自1981年以來����,國際上試圖采用基因工程技術(shù)來生產(chǎn)重組人血清白蛋白替代血漿提取,但在技術(shù)上一直沒有獲得突破���。主要原因是:①人血清白蛋白在臨床上使用劑量高、用量大(10g至20g級別)�����,對重組人血清白蛋白的安全性和成本要求極高��,重組人血清白蛋白技術(shù)不僅要求純度高(>99.9999%),且要求宿主細胞雜質(zhì)安全性好�����;②由于市場需求量巨大����,對規(guī)模化生產(chǎn)和環(huán)保要求也非常高�。在形成上百噸人血清白蛋白產(chǎn)能規(guī)模的同時���,在經(jīng)濟上也要求重組人血清白蛋白生產(chǎn)成本低�����,且對環(huán)境影響小。
2007年����,日本田邊三菱制藥株式會社研發(fā)的通過畢赤酵母表達體系生產(chǎn)的重組人血清白蛋白Medway獲批上市���,但是由于其試驗數(shù)據(jù)涉嫌造假����,于2009年撤市。除此之外�,其它公司的產(chǎn)品��,如賽多利斯集團(Albumedix公司)、VentriaBioscience的重組人血清白蛋白均只可用作藥用輔料或科研試劑�。中國采用生物技術(shù)制備人血清白蛋白的研究正在快速發(fā)展��,其中上海安睿特/通化安睿特由酵母表達和發(fā)行人由水稻胚乳細胞表達的重組人血清白蛋白藥品均已經(jīng)完成了II期臨床試驗,深圳普羅吉由酵母表達的重組人血清白蛋白藥品處于I期臨床試驗階段��;海正藥業(yè)�、華北制藥和發(fā)行人藥用輔料級別的重組人血清白蛋白已經(jīng)完成NMPA或FDA的藥用輔料登記����。
中金企信國際咨詢公布的《2023-2029年人血清白蛋白藥物市場發(fā)展戰(zhàn)略及投資前景預(yù)測咨詢報告》
(3)中國人血清白蛋白的市場需求:
①臨床藥品需求:人血清白蛋白藥品的臨床需求量十分可觀,2016年至2021年���,我國人血清白蛋白藥品的批簽發(fā)量逐年上升,但受限于原料來源���、生產(chǎn)方式與監(jiān)管機制等問題,相比于臨床上的用藥需求而言��,我國人血清白蛋白市場仍存在較大缺口���。
2020年���,中國人血清白蛋白治療藥物市場規(guī)模達到258億元人民幣�����,2025年預(yù)計達到425億元人民幣�,復(fù)合年均增長率10.5%�����,2030年市場規(guī)模預(yù)計570億元人民幣����,2025年至2030年復(fù)合年均增長率6.0%����。截至2022年11月30日,我國乃至全球市場尚未有重組人血清白蛋白上市藥品在售����,市場上只有通過血漿提取得到的人血清白蛋白藥品。目前����,在國內(nèi)有三款重組人血清白蛋白藥品處于臨床試驗階段�����。未來隨著重組人血清白蛋白藥品的上市,重組人血清白蛋白藥品憑借其產(chǎn)量大�、療效好�����、安全性佳、成本低的優(yōu)勢�,我國人血清白蛋白治療藥物市場的臨床需求缺口將得到填補����,進口依賴的現(xiàn)象也將得到改善�����,故人血清白蛋白治療藥物市場的規(guī)模將相應(yīng)快速增長�。
②藥用輔料��、科研試劑需求:非藥用白蛋白產(chǎn)品包括藥用輔料�、培養(yǎng)基級別等的人血清白蛋白產(chǎn)品���。其中,人血清白蛋白作為藥用輔料是理想的藥物載體、保護劑���,且可以作為藥物長效化的有效手段,預(yù)計將隨著蛋白藥物、疫苗、細胞和基因治療以及長效化藥物產(chǎn)品等市場的快速發(fā)展而需求量上升,由此驅(qū)動,藥用輔料的人血清白蛋白市場將穩(wěn)步增長�����。在培養(yǎng)基應(yīng)用方面��,人血清白蛋白是許多無血清細胞培養(yǎng)系統(tǒng)的重要成分之一,由于其不含有動物源成分�����,可減少動物源病毒傳播和污染的潛在風(fēng)險�,加之良好的產(chǎn)品均一性、批間一致性和規(guī)模效應(yīng)帶來的成本優(yōu)勢��,預(yù)計培養(yǎng)基級別的人血清白蛋白需求量將穩(wěn)步提升���。
2020年���,中國非藥用人血清白蛋白市場規(guī)模達25億元人民幣�,預(yù)計2025年達到56億元人民幣,復(fù)合年均增長率為17.8%�����,2030年市場規(guī)模預(yù)計90億元人民幣�,2025年至2030年復(fù)合年均增長率為10.0%。
(4)中國人血清白蛋白的供給及市場競爭
1)人血清白蛋白藥品的供給及市場競爭:
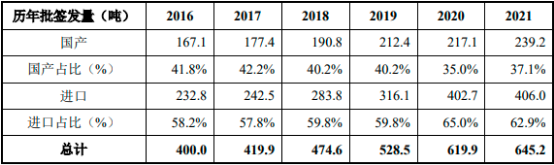
①血漿來源人血清白蛋白(pHSA)市場:2016年至2021年����,我國人血清白蛋白批簽發(fā)量穩(wěn)步增長�,從2016年的400.0噸增長至2021年的645.2噸��。按產(chǎn)地拆分��,進口產(chǎn)品批簽發(fā)量占比約60%,呈現(xiàn)出嚴重依賴進口的情況�����。2020年受新冠疫情的影響�,我國國產(chǎn)人血清白蛋白的批簽發(fā)量與2019年基本持平���,國產(chǎn)占比略有下降���。2021年我國國產(chǎn)人血清白蛋白批簽發(fā)量較2019年及2020年得到大幅提升����,國產(chǎn)占比也有所增加。
2016-2021年中國人血清白蛋白批簽發(fā)量現(xiàn)狀分析
 ?
?
數(shù)據(jù)整理:中金企信國際咨詢
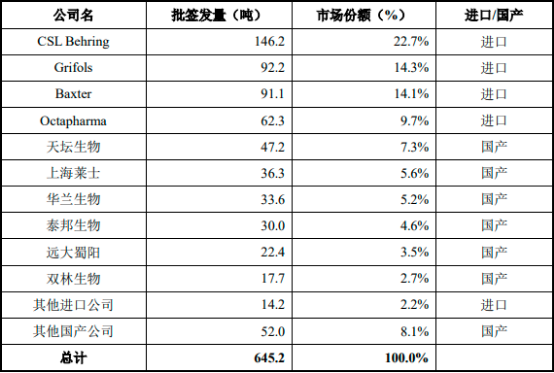
中國人血清白蛋白藥品市場中,排名前四的均為境外企業(yè)。2021年,這四家境外企業(yè)生產(chǎn)的人血清白蛋白批簽發(fā)量占整體市場的60.8%�,進口依賴較為嚴重�。國產(chǎn)企業(yè)中��,天壇生物為最大的人血清白蛋白藥品生產(chǎn)企業(yè)��,但僅占據(jù)了7.3%的市場份額。
2021年中國前十大人血清白蛋白生產(chǎn)商分析(按批簽發(fā)量拆分)
 ?
?
數(shù)據(jù)整理:中金企信國際咨詢
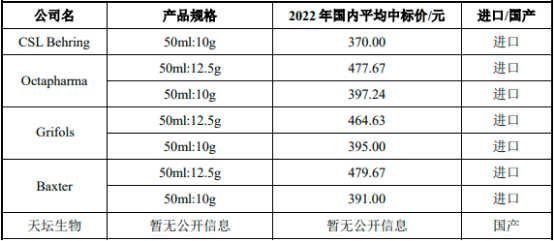
國內(nèi)人血清白蛋白藥品平均中標(biāo)價多年來一直維持在380元(50ml:10g規(guī)格)左右�,主要原因如下:①中國人血清白蛋白市場長期處于供不應(yīng)求的狀態(tài)�,2001年后國家無新批血制品生產(chǎn)企業(yè)��,目前國內(nèi)僅有約30家企業(yè)具有血制品生產(chǎn)資質(zhì)���,且新建單采血漿站門檻較高�����,血漿供給端的短缺導(dǎo)致人血清白蛋白藥品存在較大的市場缺口。②國產(chǎn)血液制品主要采用院外銷售模式�,院外市場銷售占比在一半左右�,價格受帶量采購政策的影響較小���。2022年1月19日����,廣東11省聯(lián)盟公布了276個帶量采購品種。從《廣東聯(lián)盟雙氯芬酸等藥品集中帶量采購(第二批)擬中選/備選結(jié)果公示表》中可以看出人血清白蛋白藥品的價格依舊維持在380元(50ml:10g規(guī)格)左右。
2022年中國前十大人血清白蛋白生產(chǎn)商國內(nèi)平均中標(biāo)價分析
 ?
?
?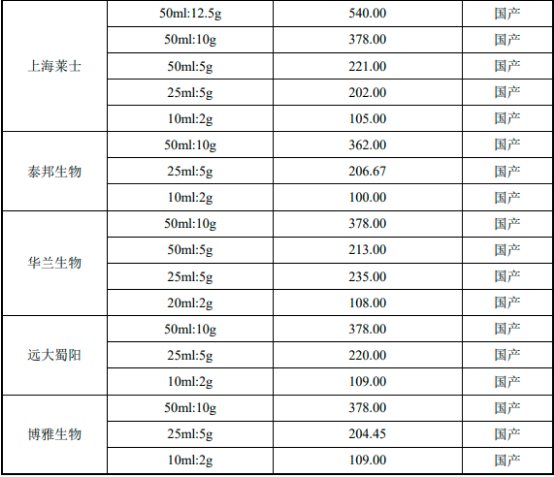
數(shù)據(jù)整理:中金企信國際咨詢
②重組人血清白蛋白藥品市場:截至2022年11月30日,全球市場尚未有重組人血清白蛋白上市藥品在售。日本田邊三菱制藥株式會社通過畢赤酵母表達系統(tǒng)生產(chǎn)的重組人血清白蛋白藥物Medway于2007年獲得PMDA批準(zhǔn)上市����,但是由于該藥物試驗數(shù)據(jù)涉嫌造假����,已于2009年撤市�。目前,全球市場上只有通過血漿提取得到的人血清白蛋白藥品�����。
全球已獲批(含撤市)重組人血清白蛋白藥品分析
 ?
?
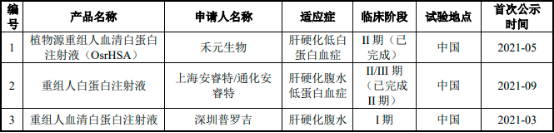
在研藥品方面��,全球范圍內(nèi)在研的重組人血清白蛋白藥品數(shù)量極少�����,具體情況如下:
全球在研用于低白蛋白血癥的重組人血清白蛋白(藥品)分析
 ?
?
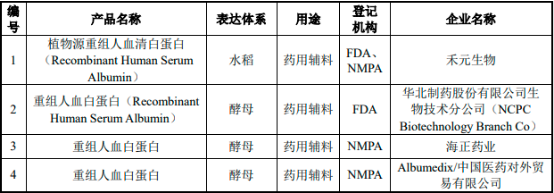
2)藥用輔料、科研試劑的重組人血清白蛋白供給及市場競爭:截至2022年11月30日��,有4家企業(yè)的重組人血清白蛋白作為藥用輔料完成了NMPA和/或FDA的登記�����,具體情況如下:
NMPA和/或FDA登記的重組人血清白蛋白(藥用輔料)分析
 ?
?
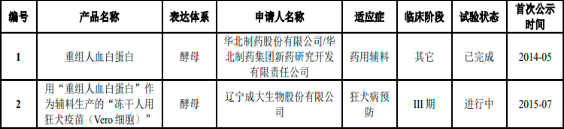
進一步藥用輔料的臨床試驗和關(guān)聯(lián)審評方面�,截至2022年11月30日�����,上述登記產(chǎn)品中��,Albumedix公司的產(chǎn)品Recombumin已應(yīng)用于美國默克(Merck)公司的麻腮風(fēng)三聯(lián)疫苗以及諸多在研藥品的生產(chǎn)當(dāng)中。國內(nèi)生產(chǎn)的重組人血清白蛋白作為藥用輔料進入臨床階段的為華北制藥通過酵母表達系統(tǒng)生產(chǎn)的重組人血白蛋白���。華北制藥于2011年啟動重組人血白蛋白在中國健康受試者中的耐受性和安全性研究的臨床試驗。臨床總結(jié)顯示其生產(chǎn)的重組人血白蛋白對中國健康受試者安全性和耐受性達到預(yù)期目標(biāo)�。進一步其重組人血白蛋白產(chǎn)品作為藥用輔料與遼寧成大生物股份有限公司的狂犬疫苗組合開展了III期臨床試驗�,根據(jù)CDE公開信息���,試驗?zāi)壳叭栽谶M行中���。
中國進入臨床試驗的重組人血清白蛋白(作為藥用輔料)記錄分析
 ?
?
除了作為藥品或者藥用輔料����,用于科研試劑及其他方面的植物源重組人血清白蛋白商業(yè)化市場中��,全球較為成熟且有一定市場認可度的主要生產(chǎn)方包括禾元生物�����、VentriaBioscience、賽多利斯集團(Albumedix公司)等公司�����。
?
免責(zé)聲明:
本站新聞�����、行業(yè)資訊、新聞資訊、市場資訊等公開信息中部分內(nèi)容與圖片來自網(wǎng)絡(luò)、媒體或網(wǎng)友(含三方合作機構(gòu))提供����,版權(quán)歸原作者��。中金企信本著尊重與保護知識產(chǎn)權(quán)的原則���,若出現(xiàn)本站公開內(nèi)容存在文章內(nèi)容或圖片內(nèi)容版權(quán)與其他問題請聯(lián)系我司�。聯(lián)系方式:010-63853556��,zqxgj2011@163.com�,我司將第一時間回應(yīng)并處理��。
?