2021年基因治療行業市場運營規模前景預測及投資競爭戰略可行性規劃研究
?
1、基因治療行業簡介:
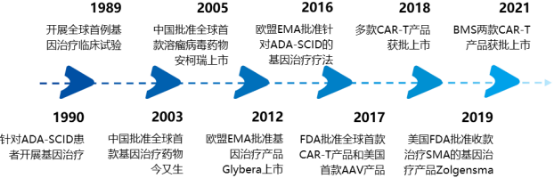
(1)基因治療發展歷史:
 ?
?
基因治療與分子生物學、基因組學、基因編輯技術等基礎科學的發展關聯十分密切。20世紀50年代以前,人們對于基因遺傳的了解非常有限。自1953年DNA雙螺旋結構模型提出后,基因的化學本質和分子結構得到確定,相關理論研究和技術開發取得了巨大進步,為基因的復制、轉錄、表達和調控等方面的研究及應用奠定了基礎。基因治療的發展歷史主要如下:
1972年,Friedmann和Roblin首次提出基因治療的概念;1984年,腺相關病毒被首次用作基因遞送載體;1990年,FDA正式批準了第一個基因治療臨床試驗;1991年,人類首次對溶瘤病毒進行了基因改造,使溶瘤病毒治療成為可能;2002年,科學家首次在實驗室條件下研發出了可有效存活、復制并清除前列腺癌細胞的CAR-T細胞,證實了CAR-T治療的可行性。
2003年,全球首個基因治療藥物重組人p53腺病毒注射液(商品名:今又生/Gendicine)在中國獲批;2005年,由腺病毒改造而來的溶瘤病毒治療產品安柯瑞(Oncorine)在中國獲批上市,用于治療鼻咽癌,為全球第一個獲批的溶瘤病毒藥物,至此,中國成為首個批準基因療法上市的國家。
2012年,第一種基于AAV的基因治療藥物Glybera獲EMA批準上市;2015年,Amgen公司的黑色素瘤治療藥物Imlygic成為FDA和EMA批準的首款溶瘤病毒治療產品;2017年,美國公司SparkTherapeutics的基因療法Luxturna獲批上市,成為FDA批準的首款基于AAV的基因療法;
2017年,諾華的Kymriah成為全球首個獲FDA批準的CAR-T產品,KitePharma的Yescarta成為全球第二款獲FDA批準的CAR-T產品;2020年,KitePharma的CAR-T產品Tecartus獲FDA批準上市;2021年,JunoTherapeutics(現BMS旗下)的CAR-T產品Breyanzi獲FDA批準上市;2021年3月,BMS的CAR-T產品Abecma獲FDA批準上市。
近年來,在基礎生命科學和前沿生物科技進步的推動下,全球創新藥行業的發展逐步達到新的臨界點;以基因療法為代表的新一代精準醫療快速興起,發展趨勢明晰,對以小分子和大分子藥物為主的創新藥市場起到了重要的補充、迭代和開拓作用。近年來,諾華、安進、百時美施貴寶等跨國新藥研發巨頭通過自研或收購方式,廣泛布局基因治療,其獲得FDA和EMA批準上市的基因治療藥物持續增加,覆蓋適應癥不斷拓展,部分重要藥物已納入美國、英國、日本等多個發達國家的醫保體系。
如同小分子藥物、抗體藥物引領生物醫藥的前兩次產業變革,基因治療將引領生物醫藥的第三次產業變革;參照2002年首個全人源單抗藥物阿達木單抗(商品名:修美樂)上市后,全球大分子藥物領域開啟了20年的高速發展并仍保有較大增長潛力,基因治療領域自2017年若干里程碑CAR-T產品上市后進入快速發展階段,并有望在未來15-20年成為主要的創新藥類別之一。
中金企信國際咨詢公布的《2021-2027年中國基因治療行業市場全景調研分析及投資可行性研究預測報告》
(2)基因治療優勢及特點:
1)基因治療的優勢:基因療法靶向DNA,能夠克服傳統小分子和大分子抗體藥物在蛋白質水平進行調控的局限性,使得根治遺傳性疾病成為可能。基因治療的主要優勢,即在于其單次治療的長期化效果及對難治性適應癥的覆蓋。
①單次治療的長期療效優勢:基因療法的一大優勢在于單次治療帶來的長期療效。以治療脊髓性肌萎縮癥(SpinalMuscularAtrophy,SMA)為例,SMA由于SMN基因的雙等位缺失或突變,導致脊髓內的α-運動神經元變性萎縮,引起患者身體軀干和四肢近端骨骼肌發生漸進性、對稱性肌無力、肌萎縮等癥狀,并逐漸喪失呼吸、吞咽等各種運動功能,兒童群體中的SMA發病率約在1/5000-1/10000。
基于遺傳學基礎,治療SMA需要增加具有完整功能的SMN蛋白含量。諾華研發的Zolgensma是一種利用AAV9載體遞送SMN1基因靶向脊髓運動神經元的全新基因療法,同需要終身服藥的小分子藥物療法相比,只通過一次靜脈注射,便可實現長期、穩定的治療效果,一次性治愈遺傳病。根據START臨床試驗數據,Zolgensma在給藥后的近四年內未減弱療效。
②為難治性疾病治療提供新選擇:基因治療的另一大優勢,是為對于傳統療法效果不佳的難治性疾病提供了新的治療選擇。例如,急性淋巴細胞白血病是一種起源于T系淋巴祖細胞的惡性腫瘤,通過在骨髓中異常增生聚集并抑制正常造血,導致貧血、血小板減少和中性粒細胞減少,同時侵及髓外組織,引起相應病變。目前,治療急性淋巴細胞白血病的主要方法之一為聯合化療方案,盡管該方案具有一定治療效果,但仍存在部分化療無效或化療后復發的患者。2017年,諾華研發的Kymriah成為全球首個獲FDA批注的CAR-T產品,用于治療難治或復發性B細胞前體急性淋巴細胞白血病,為化療無效或復發的患者提供了新的治療選擇。
2)基因治療特點:
①以基因治療載體為核心:基因治療藥物的核心是將治療性基因片段遞送至特定細胞,而基因治療載體決定了遞送效率、靶向性、以及臨床給藥方式等基因治療藥物的關鍵屬性,并最終影響藥物的臨床藥效、安全性和商業化成本。因此,針對基因治療載體的開發和改造、生產工藝及質量控制是基因治療的核心開發內容,也是基因治療CDMO企業技術、商業競爭力的主要所在。
②有別于傳統藥物的轉化機制:傳統藥物行業經過長時間的發展,技術和產業化相對成熟,藥物研發主要由大型制藥企業主導;基因療法起步較晚,真正意義上的產業化系始于2017年首個CAR-T療法Kymriah上市。相較于傳統藥物,基因治療與生物醫學基礎研究關聯緊密,轉化機制亦有所區別:基因治療先導研究主要由高校、科研院所和醫療機構推動,基因治療藥物的技術孵化通常源于實驗室研究。因此,缺乏產業化管理經驗成為了制約基因治療藥物轉化的重要因素之一,也使得該領域對研發和生產外包服務的依賴性更強。
根據JAMA雜志2020年3月刊,在納入統計的341項美國基因治療臨床試驗中,接近50%的臨床I期與II期試驗項目獲得過來自學術界的資助,表明基因治療藥物研發具有較強的基礎研究臨床轉化特點。
③初創企業為主,高度依賴CDMO產業化服務:基因治療領域發展時間不長,除少數大型制藥公司近年來布局基因治療業務外,大多數參與者均為初創公司。基因治療產品研發和生產難度大、周期長、成本高,其中,藥物發現和臨床前階段的研發投入約為9-11億美元,臨床階段的研發投入約為8-12億美元。基因治療初創新藥企業在藥物開發、臨床申報至商業化生產過程中,由于受到工藝開發能力、GMP生產經驗、臨床申報相關法規知識的限制,高度依賴專業的研發和生產外包服務。統計數據顯示,基因治療外包滲透率超過65%,遠超傳統生物制劑的35%。
中金企信國際咨詢專業編制《基因治療項目商業計劃書》為企業投融資、項目立項、銀行貸款申請、批地申請等提供專業化優質服務。
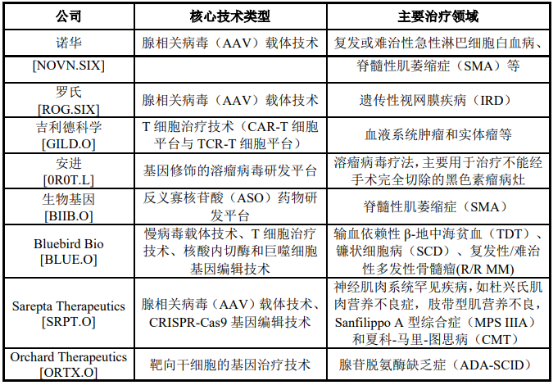
(3)基因治療行業格局:目前,全球領先的基因治療新藥公司的核心技術多為腺相關病毒載體技術,治療領域集中于各類罕見疾病。
全球主要基因治療藥物研發公司分析
 ?
?
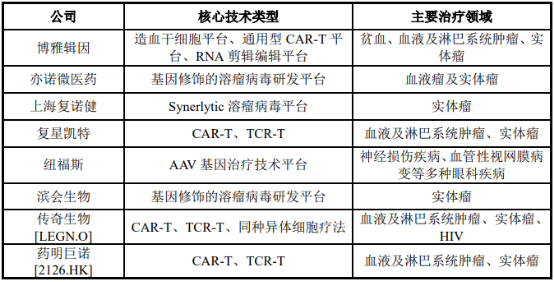
國內基因治療新藥公司主要專注于CAR-T、TCR-T等免疫細胞產品,以及基因修飾溶瘤病毒產品,治療領域為血液瘤、淋巴系統腫瘤、實體瘤等。
中國主要基因治療藥物研發公司分析
 ?
?
(4)基因治療市場規模及前景:
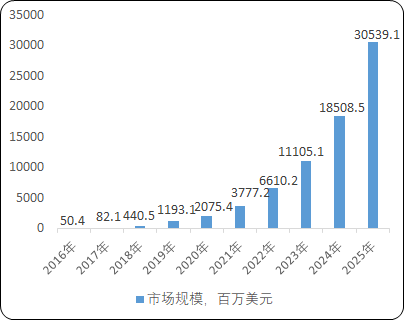
1)全球基因治療市場規模及前景:2015年以來,全球基因治療行業開始高速發展。從2016年到2020年,市場規模從5,040萬美元增長到20.8億美元,預計到2025年,全球基因治療市場規模將達到近305.4億美元。
2016-2025年全球基因治療市場規模現狀及預測
 ?
?
數據統計:中金企信國際咨詢
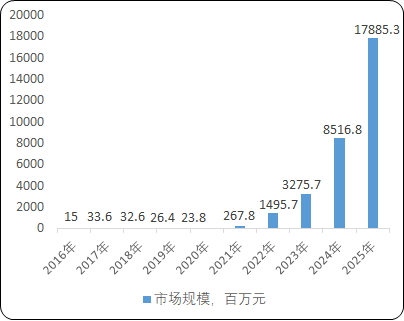
2)中國基因治療市場規模及前景:2016年-2020年,基因治療市場規模從1,500萬元增長到2,380萬元,增長幅度尚不明顯。但隨著基因治療近年來臨床試驗的大量開展、基因治療產品的陸續預期獲批上市、相關利好產業政策的支持,預計國內基因治療市場規模將快速擴大,到2025年將達到178.9億元。
2016-2025年中國基因治療市場規模現狀及預測
 ?
?
數據統計:中金企信國際咨詢
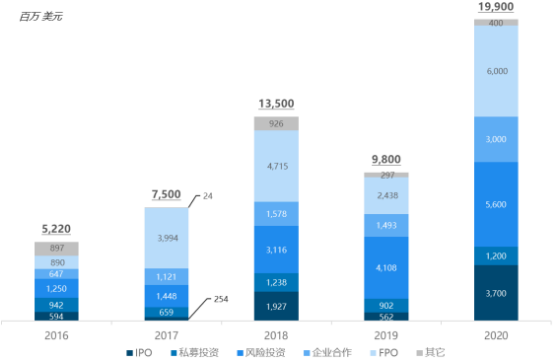
3)基因治療融資及行業并購:2015年以來,全球基因治療行業加快發展,行業融資不斷升溫,風險投資、私募投資、IPO十分活躍。特別在2017年以后,隨著腺相關病毒藥物Luxturna和2款CAR-T藥物Kymriah和Yescarta的上市,基因治療行業迅猛發展,行業融資總額從2017年的約75億美元大幅增長至2020年的199億美元。
2016-2020年全球細胞和基因治療行業投融資現狀分析
 ?
?
數據統計:中金企信國際咨詢
中金企信國際咨詢專業編制《基因治療項目可行性研究報告》為企業投融資、項目立項、銀行貸款申請、批地申請等提供專業化優質服務。
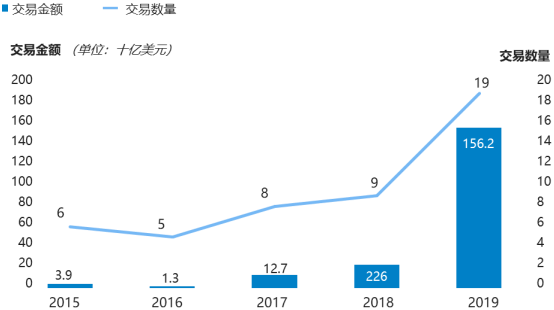
同時,基因治療領域并購規模快速擴大,于2019年爆發增長至1,562億美元。并購活躍度的顯著提高,反映了行業加快的整合趨勢和強勁的發展態勢。
2015-2019年全球細胞和基因治療領域交易現狀分析
 ?
?
數據統計:中金企信國際咨詢
?